【财新网】辉瑞公司和BioNTech周一表示,他们的三剂新冠疫苗在5岁以下儿童中产生强烈的免疫反应,在其临床试验中安全且耐受性良好,计划很快寻求全球监管机构批准为该年龄组的儿童注射疫苗。
目前世界上大多数国家都没有批准该疫苗用于5岁以下年龄组接种。路透社报道,两家公司称,预计本周将完成向美国食品和药物管理局(FDA)提交的数据。
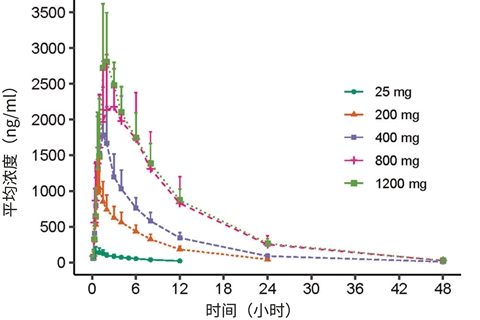
该临床试验涉及给1678名6个月至5岁以下的儿童注射比大龄儿童和成人更小剂量的疫苗。辉瑞公司和BioNTech公司在一份新闻稿中说,三针3微克配方的疫苗在该年龄组产生的免疫反应与在早期临床试验中接受两针30微克配方疫苗的16至25岁儿童相似。
BioNTech首席执行官Ugur Sahin在声明中称:"这项研究表明,根据耐受性数据选择的3微克低剂量疫苗为幼儿提供了针对最近COVID-19菌株的高水平保护。”竞争对手疫苗制造商Moderna在3月发布的试验数据显示,其疫苗在幼儿中产生的免疫反应与成人相似。
辉瑞公司和BioNTech公司称,对截至4月29日发现的10个有症状的COVID-19病例的早期分析表明,在Omicron变体占主导地位时,5岁以下年龄组的疫苗疗效为80.3%。但这一分析并非最终结论,因试验方案规定疗效应根据至少21个病例计算。两家公司表示,该年龄组的最终疗效数据将在获得后公开。
报道称,此前,上述两家公司曾在儿童身上测试两剂3微克的疫苗。但在2至4岁儿童的试验结果显示免疫反应比成人弱后,两剂量的试验未能达到其主要终点。试验参与者在第二次注射后至少两个月接受了第三剂量。辉瑞公司表示,该疫苗耐受性良好,大多数不良副作用轻微或中等。
辉瑞公司/BioNTech的疫苗目前被授权用于所有5岁及以上的美国人。5至11岁的儿童接受两个10微克的剂量作为主要疗程,而12岁及以上的人接受两个30微克的剂量。目前还不清楚有多少美国父母会给孩子接种该年龄组的疫苗。目前只有29%的5至11岁美国儿童完全接种疫苗,而且新冠在儿童中一般比成人更温和。
美国监管机构已在准备审查低龄儿童的数据,以及Moderna公司提交的6岁以下儿童的数据。美国食品和药物管理局周一表示,其外部顾问委员会将于6月15日举行会议,以审议这两种疫苗在最年轻儿童中的使用。