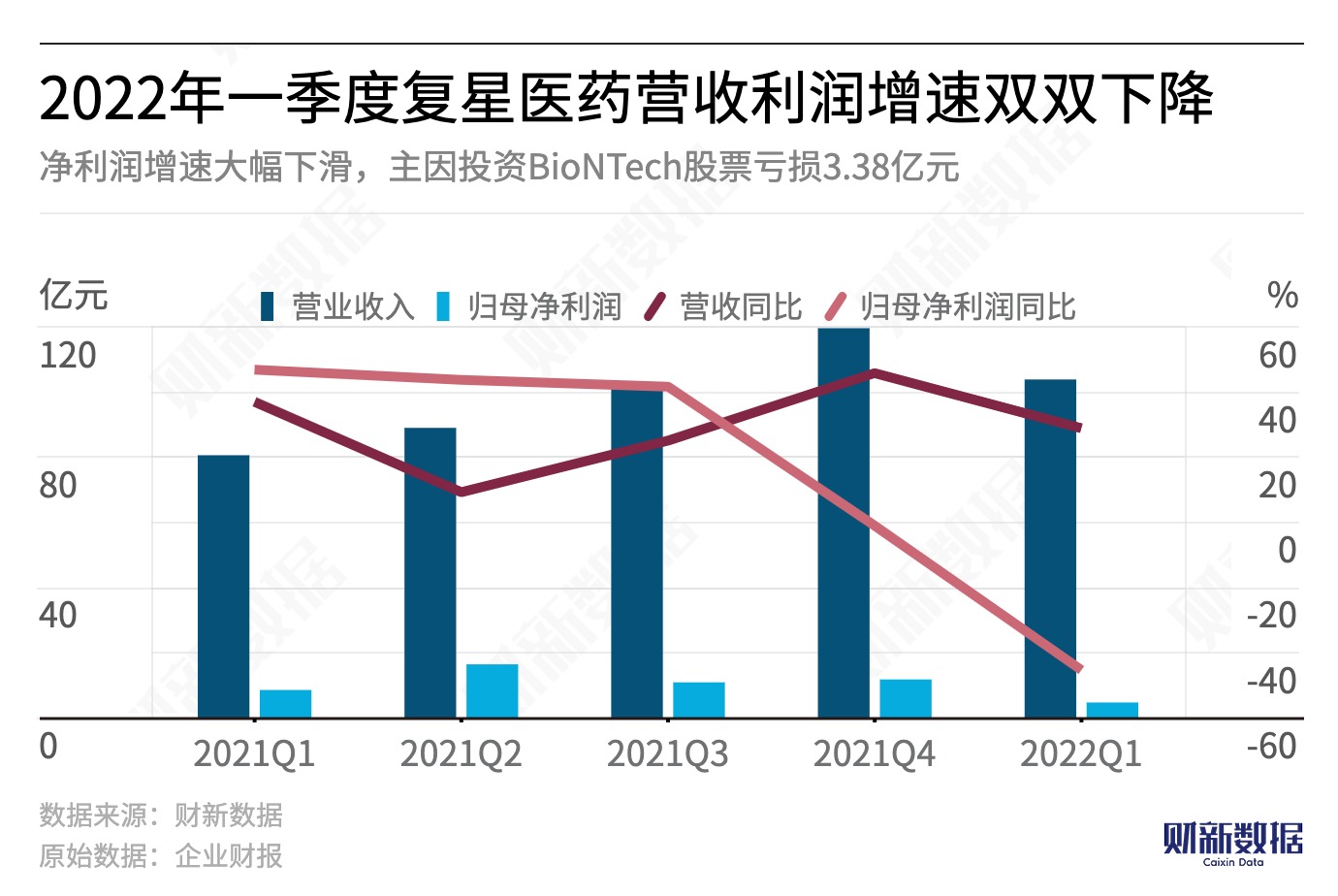
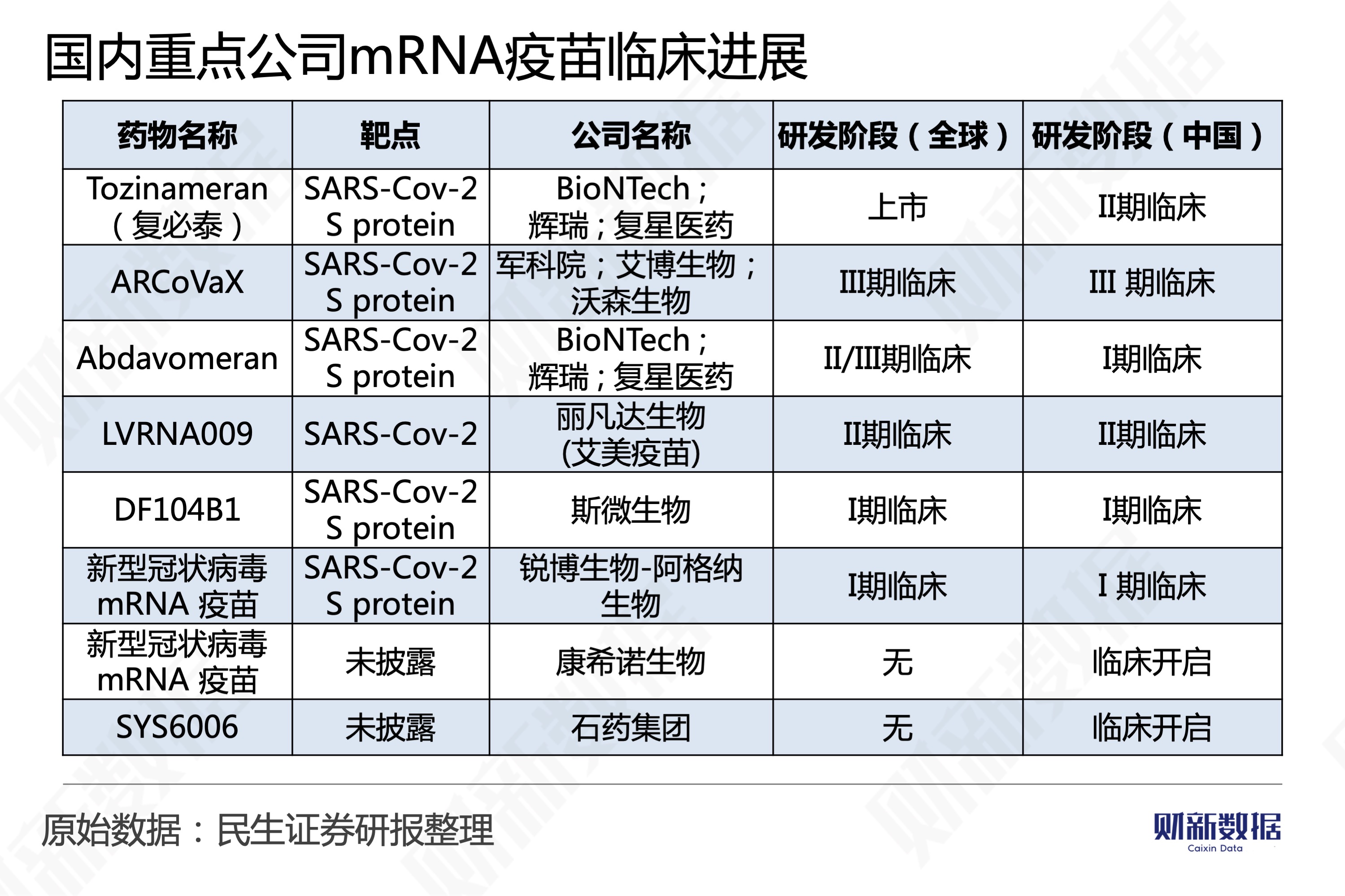
【财新网】时隔一年半后,复星医药(600196.SH,02196.HK)与德国疫苗公司BioNTech(NASDAQ:BNTX)合作的mRNA疫苗BNT162b2(商品名为“复必泰”)朝着进入中国市场再迈进一步。
美国临床试验数据库(ClinicalTrials.gov)显示,5月10日,复必泰在中国的临床试验更新了研究进展,II期临床试验的状态从“进行中”变更为“已完成”,这项临床研究在2022年1月9日完成。
美国临床试验数据库由美国国立卫生研究院(NIH)和美国食品药品监督管理局(FDA)合作开发,向公众提供各类临床试验信息,研究机构可在该数据库更新研究动态。
这项临床试验旨在研究BNT162b2疫苗在中国健康人群中的安全性和免疫原性,参与试验的有950人,年龄在18至85岁之间,由复星医药于2020年12月负责开展,试验地在江苏省疾病预防控制中心。
据德国证券网站BÖRSE ONLINE报道,BioNTech一名发言人对此称,“我们已向(中国)相关主管部门提交了一份全面的数据包,主管部门正在审阅文件,并根据这些数据评估疫苗,结果将由当局宣布。”
截至发稿,复星医药尚未回复财新对复必泰II期临床试验进展的查询。
一般而言,新冠疫苗要在国内上市,都要经过临床前试验、I至III期临床试验、注册审批等流程,其中,三期临床试验的作用是全面评估疫苗的有效性和安全性。
不过,由于复必泰已在国外进行过III期临床,积累了大量数据,流程上可以简化。复星医药高级副总裁、全球研发总裁兼首席医学官回爱民曾对媒体称,复星医药计划以桥接方式结合BNT162b2在海外进行的III期临床试验结果,一起向国家药品监督管理局报批上市。这意味着,这款疫苗在海外积累的数据可以和II期临床试验结果一并提交,无需重复III期临床。
5月9日,国家药监局综合司发布的《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》中,第二十三条为“申请人在境外取得的临床试验数据,符合国务院药品监督管理部门规定要求的,可用于药品上市许可申请。”这也为复星医药用BNT162b2在海外的III期临床数据报批提供了政策依据。
事实上,这款疫苗在海外的III期试验数据早已公布。2021年8月23日,BNT162b2疫苗的上市申请(Biological lisence application,BLA)获得了FDA正式批准。当年5月申请BLA时,BioNTech披露了完整的III期临床试验数据:对46307例疫苗接种受试者的临床研究结果显示,接种2剂疫苗后的7天至6个月内,疫苗的有效性为91.3%,安全性也达到上市的标准。
复必泰进入中国大陆之路走得异常缓慢。早在2020年7月,复必泰就获国家药监局临床试验注册审评受理,复星医药随机开展了I期临床试验。II期临床试验在2020年12月启动,但此后的一年时间内均未更新进展,停留在了行政审批阶段。
2022年3月23日,复星医药董事长吴以芳在业绩媒体沟通会上介绍,复必泰在中国大陆申报上市的进度还在审评审批当中。
与此同时,港澳台地区已经将复必泰当作“主力”疫苗。据复星医药4月26日披露的2022年一季报,截至2022年3月末,复必泰于港澳台地区累计接种超2400万剂,仅3月份的接种量就达到400万剂。(详见财新网报道《复星医药称“复必泰”港澳台接种超2200万剂》)